
目錄
- 致病因子、流行病學與致病機轉
- 臨床表現
- 診斷
- 新型病毒株與其他疾病混合感染
- 控制與免疫

1. 致病因子、流行病學與致病機轉
豬小病毒 (簡稱 PPV; Ungulate parvovirus 1) 為一種DNA病毒,於1960年代末首次被發現,並歸類為小病毒科 (Streck; Truyen, 2020)。小病毒科由兩個亞科所組成,分別為小病毒亞科 (Parvovirinae) 與濃核病毒亞科(Densovirinae)。 本屬病毒型態微小 (Parvus為拉丁語有微小之意),皆為基因組5kb的單股DNA病毒,其中四段基因主要藉由選擇性剪接轉譯出2種結構蛋白與2種複製蛋白。小病毒含有120-200鹼基所組成的迴文夾鉗構造,位於基因體雙側末端,為細胞去氧核醣核酸 (DNA) 複製所需的必要結構。病毒複製高度依賴細胞分裂過程的S或G1期,因此以細胞增殖為主的器官為其主要影響標的,例如骨髓、胚胎細胞與腸道前驅細胞 (Zádori; Szelei; Tijssen, 2005)。
本病毒主要經由口鼻接觸或配種來感染宿主,經由胎盤感染使胚胎死亡並損害母體生殖系統的組織。(Van Leengoed et al., 1983)。本病原遍佈全球養豬產業,可見於各類豬群。豬小病毒的構造簡單,不僅能抗高溫,對pH值變化耐受性強且對各式化學消毒劑具有良好的抵抗力 (Paul et al., 2003)。此病毒通常可於器械、畜舍、工作服、雨鞋與設備上存活數個月之久,並藉此途徑在豬群間持續傳播。
豬小病毒侵入細胞的機制尚未完全明瞭,但病毒可能是藉由網格蛋白所調節的細胞吞噬作用或微胞飲現象等體內途徑進入細胞核並展開複製,最後導致氧化傷害及引起細胞凋亡。病毒首先會在淋巴組織進行複製,經由病毒血症擴散至全身,後續胚胎感染的發生則是由於胚胎組織呈現高度有絲分裂活動使得環境有利於病毒感染與複製 (Boisvert; Fernandes; Tijssen, 2010; Paul; Mengeling, 1980; zhao, x. 2016)。
科學上至今仍不清楚豬小病毒是如何通過胎盤屏障,畢竟這是連抗體都無法通過的複雜縝密結構,不過由於此病毒被巨噬細胞吞噬後仍能保有感染能力,所以目前最合理的推測是此病毒可躲藏於巨噬細胞內,接著通過胎盤上皮細胞進而感染胎兒 (Paul; Mengeling, 1980)。豬小病毒的毒力特性似乎與病毒蛋白基因有關,在體外試驗中將豬小病毒分為具致病性與不具致病性的重組病毒,結果觀察到改變核體蛋白的單一胺基酸即可影響重組病毒在某些細胞株的複製能力,進而大幅改變此病毒在胚胎細胞內的致病能力 (Boisvert; Fernandes; Tijssen, 2010; Streck; Truyen, 2020)。
圖1 : 豬小病毒殼體的3D立體圖。DOI: 10.2210/pdb1K3V/pdb
2. 臨床表現
在大部分情況下,豬小病毒若感染未懷孕母豬不會呈現任何臨床症狀,最常見的臨床表現是懷孕母豬的繁殖障礙,尤其常見於新女豬初產的情況下 (Truyen and Streck, 2019)。 豬小病毒的典型繁殖障礙特徵是出現異常大量的木乃伊胎,此外在母豬懷孕早期被感染的胚胎會因死亡而被母體重吸收,進而導致窩仔數的減少 (Mengeling et al., 2000)。
生殖系統的臨床症狀與母豬懷孕的階段密切相關,在懷孕初期,胚體受透明帶保護因此不容易受到豬小病毒的感染,進入胚胎階段後,感染將導致胚胎的死亡與重吸收。自懷孕的第35天起,胎兒感染會導致死亡而木乃伊化,此後大約在懷孕第70天,胎兒便能夠發揮有效的免疫反應以清除病毒 (Mengeling et al., 2000)。
豬小病毒感染的病變具特徵性並且局限於子宮及胎兒,肉眼觀察下可見感染胎兒體型不良、鬱血、水腫、出血及體腔內血樣液體蓄積與組織脫水造成其木乃伊化 (Mengeling, 1999)。顯微鏡檢查下主要可見多重組織細胞壞死以及單核炎症細胞浸潤 (Joo; Johnson, 1977; Hogg et al., 1977)。在懷孕母豬,顯微病變則在子宮內膜、黏液以及子宮肌層,可見內皮細胞肥大以及單核炎症細胞浸潤等炎症反應 (Hogg et al., 1977)。

圖2: 確診為豬小病毒感染引起的木乃伊胎。圖片來源:HIPRA海博萊公司
3. 診斷
豬小病毒感染可運用多種實驗室技術檢測抗體與病毒以進行確診,其中血清學檢測可有效確認豬隻的免疫狀態以及評估垂直傳播的情形,進而從抗體高峰結果察覺有病毒循環感染的豬群 (Mengeling et al., 1999)。血球凝集抑制法 (HI) 為檢測豬小病毒抗體的標準方法,其成本低而且能檢測抗體力價。酵素結合免疫吸附分析法 (ELISA) 則擁有許多優點,如機器自動判讀、高再現性以及方便使用的商業化檢測套組,因此被認為和血球凝集抑制法一樣實用 (Truyen and Streck, 2019)。
豬小病毒在豬腎臟或睪丸細胞裡的複製效率高,故運用細胞培養分離病毒可做為診斷本病的依據,常用的有PK-15 (豬腎細胞)、SK-6 (豬腎細胞)、STE (豬睪丸細胞)、ESK (豬胚胎腎細胞) 與SPEV (豬胚胎腎細胞) 等 (Truyen and Streck, 2019)。一般來說,此病毒在複製過程中會諸多細胞病變效應,例如:顆粒化、型態不規則、增殖緩慢、細胞核內包涵體與核濃縮等,最終會造成細胞死亡 (Cartwright et al., 1969; Mengeling, 1972)。但由於其他病毒也能造成類似的上述細胞病變或酶促反應,所以病毒分離與力價測定通常仍須要聚合酶連鎖反應 (PCR) 的配合 (Truyen and Streck, 2019)。
隨著分子生物學的發展,現今已可藉由偵測特定病毒核酸序列來確診豬小病毒。聚合酶連鎖反應 (PCR) 因為具有高特異性與高敏感性特色已成為最常被使用的診斷方法,可用來檢測胎兒組織、精液與其他檢體中的病毒 (Truyen and Streck, 2019)。即時定量聚合酶連鎖反應 (real-time PCR) 除了保有傳統PCR高特異性與高敏感性的特徵外,更具有定量病毒與自動判讀結果的優勢 (Mckillen et al., 2007)。
近期研究指出,恆溫式圈環形核酸增幅法 (LAMP) 被認為是更具優勢的分生檢測選擇,相較於其他診斷技術具有高度特異性、敏感性及更快的檢測速度 (Zhao, K. et al., 2020)。

圖3:實驗室診斷設備。圖片來源:海博萊西班牙總部診斷中心。
4. 新型病毒株與其他疾病混合感染
近20年來,科學家於談論豬小病毒時會將6種新分類納入 (Figure 3),國際病毒分類委員會 (International Committee on Taxonomy of Viruses; ICTV) 藉由新的分類法,將較新型的病毒如豬第二型小病毒 (PPV2)、豬第三型小病毒(PPV3)、有蹄類第三型四小病毒 (Ungulate tetraparvovirus 3) 及有蹄類第二型四小病毒 (Ungulate tetraparvovirus 2) 歸類為四小病毒屬,而豬第四型小病毒 (PPV4) 和species Ungulate copiparvovirus 2則被編入Copiparvovirus屬。豬第五型小病毒 (PPV5) 目前尚未被ICTV歸類,但基因研究顯示該病毒與PPV4具高度相關性。豬第六型小病毒 (PPV6) 則是被ICTV公布與Copiparvovirus 屬相關 (Cotmore et al., 2019; MIŁEK et al., 2019)。豬第七型小病毒 (PPV7) 是最新發現的病毒,目前被歸類於新的 Chappaparvovirus 屬 (Palinski; Mitra; Hause, 2016)。
來自世界各地針對新型豬小病毒的研究顯示本病毒的地理分佈極為廣泛,所有種類的豬小病毒均曾在中國、美國和波蘭檢出。第二型、第三型及第四型豬小病毒在匈牙利、羅馬尼亞、日本及南非有研究報告發表。而第三型、第四型及第七型豬小病毒則分別在英國、巴西和韓國被檢測到 (Miłek et al., 2019) 。
這些新型病毒從呈現各種不同臨床症狀的豬隻被發現,其中也包含健康的豬群。它們來自於各種體液檢體與臟器檢體,如肝臟、肺臟、心臟、脾臟、腎臟、淋巴結以及扁桃腺與流產胎兒。新型豬小病毒和感染動物的健康狀況間的關聯性目前尚不清楚,從細胞培養分離出病毒及後續感染試驗的研究至今尚未有明確的結論,故仍無法斷言新型小病毒對於豬隻健康會造成何種程度的影響 (Miłek et al., 2019).
近期科學家們進行了豬小病毒與豬第二型環狀病毒 (PCV2) 複合感染症的研究並提出了觀點,當豬隻同時被豬小病毒與豬第二型環狀病毒感染後,感染豬隻的體重相較於健康豬隻會顯著下降。此外,同時感染這兩種病毒的豬隻在淋巴結可以觀察到肉芽腫性炎症反應以及淋巴流失等,典型的豬離乳後多系統消耗症候群 (PMWS) 病變,也就是現今普遍認知的第二型環狀病毒系統性疾病。通常這些複合感染的仔豬會因為兩種病毒的協同作用而出現更嚴重的病變,是因為豬小病毒感染後提供了更易於第二型環狀病毒感染的環境 (Kennedy et al., 2000; OUYANG et al., 2019; Sharma; Saikumar, 2010)。第二型環狀病毒和豬小病毒的複合感染是由於無法活化IFN-γ和TNF-α (免疫系統因子) 的早期反應,以至於延遲的低體液性免疫反應,導致持續性病毒血症 (Opriessnig et al., 2017)。
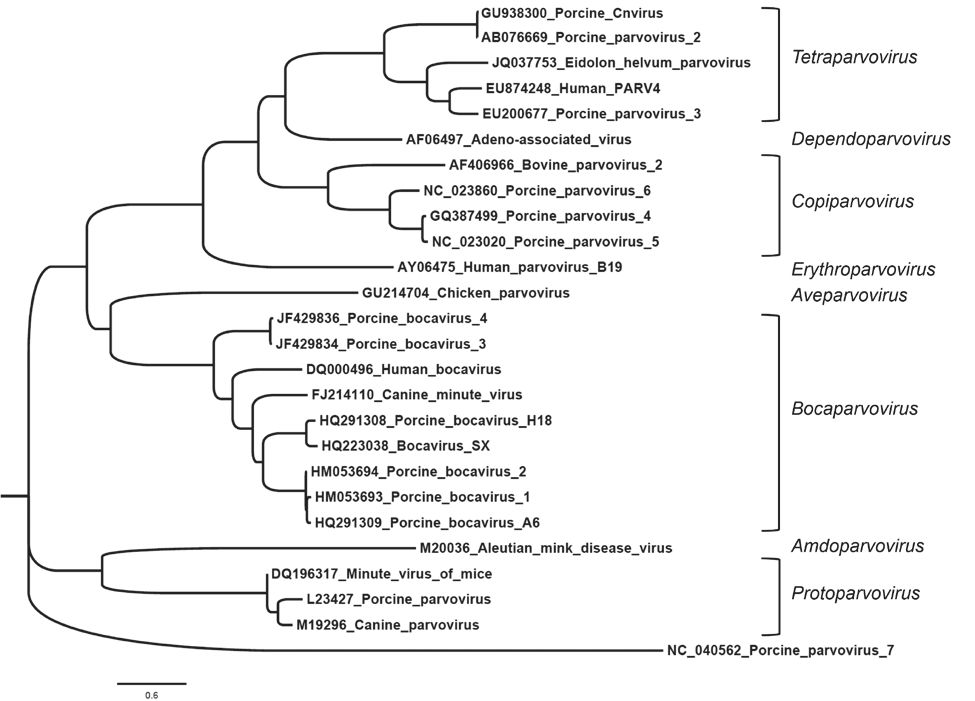
圖4:本演化史是基於最大概似估計法 (Maximum Likelihood Method) 和LG model所推斷繪製。最初始研究的分枝是以Neighbor-Join and BioNJ 演算法從母數據中自動分析,並以JTT model估算演化配對距離 (pairwise distance),再選擇superior log likelihood value。離散迦瑪分佈 (Gamma distribution) 用於模擬不同類別的演化速率 (共6種類別)。樹狀圖繪製模型的分枝長度是以鹼基替換位的數量作為單位。演化分析使用MEGA X製作 (Kumar et al., 2018)。
5. 控制與免疫
豬小病毒感染並無特定的治療方法,因此建議需徹底執行清潔消毒與管理措施來維持豬群的健康,為了使豬場的免疫力能夠保持一致,建議可以執行以下兩種措施:策略性感染或疫苗免疫。策略性感染在過去商業疫苗未普及之前常被廣泛地使用,其方法為讓新女豬群於配種前一個月直接接觸經產母豬或可能已被感染的病材 (如:糞便、胎盤及木乃伊胎等)。但這種方法有可能將其他的病原 (如藍耳病等) 散播至種豬群中,目前其實並不推薦。此外亦須考慮到到這些病材中豬小病毒的病毒量可能不足,因此無法讓所有接種豬群感染成立,自然無法達成全數豬隻血清陽轉 (Abreu et al., 2018; Truyen and Streck, 2019)。
疫苗免疫是目前最普遍用來控制豬小病毒感染的有效方法,其主要目的就是可有效刺激豬群的主動免疫能力,尤其是可避免新母豬的子宮內感染。市售疫苗主要是由不活化的病毒所製成,被認為是對抗豬小病毒感染最安全且最有效的方式,此類型針對豬小病毒的疫苗即使與其他抗原合併作為多價疫苗,仍具有良好的安全性並能提供有效的保護力。目前使用的商業疫苗雖然無法防止病毒感染與擴散,但可在種豬群產生高抗體力價以減少被感染豬隻的臨床症狀 (ZEEUW et al., 2007)。減毒活毒疫苗及其他發展中的重組疫苗或許是未來控制豬小病毒的另一種選擇,但不活化病毒疫苗由於具有高度的安全性,目前仍然是最常被使用的疫苗 (Truyen and Streck, 2019)。



